Алканы. свойства алканов
Содержание:
формула алканов
Алканы — это ациклические углеводороды линейного или разветвлённого строения, содержащие только
простые связи и образующие гомологический ряд с общей формулой CnH2n+2
(CH4, C2C6, …).
Алканы также называют парафинами. Каждый атом углерода в молекуле алкана имеет
максимальное количество связанных с ним других атомов, то есть четыре, поэтому такие углеводороды
и называют насыщенными.
Связи
Электронная конфигурация атома углерода с атомным числом 6, 1s22s22p2, не может
образовать четыре связи, а только две, поэтому здесь имело место sp3-гибридизация, то есть перераспределение
четырёх электронов с двух разных энергетических уровней на один. Образованные связи электронов углерода
(с орбитали sp3) и водорода (орбиталь s) образуют очень прочную связь σ.
Ввиду прочности связи, насыщенные углеводороды имеют низкую реакционную способность.
Геометрия
Наличие четырёх орбиталей у атома углерода создаёт форму правильного тетраэдра и все углы между орбиталями равны 109°28′.
Длина связи между атомами углерода и водорода составляет 0,109 нм, между двумя атомами углерода — 0,154 нм.
Реакции
Атомы в молекулах алканов соединены сильной σ-связью. В реакции связи C-C и C-H имеют равную
вероятность разрушиться для образования нового соединения, поэтому результатом реакции всегда
является сложная смесь продуктов. В нормальных условиях алканы не реагируют с кислотами, с основаниями, ни
с сильными окислителями.
При разрыве связи в алканах возможны два сценария: разрыв связи с образованием двух радикалов,
A:B → A• + • B. Такой разрыв называется гомолитический (гомо — одинаковый).
В другом случае происходит разрыв с образованием ионов, когда общая пара электронов отходит к одному из атомов:
A:B → A + :B, такой разрыв называется гетеролитический. Соответствующим образом называются виды
реакции алканов: гомолитические и гетеролитические реакции.
На данный момент известны два типа реакции алканов, в которых не разрываются связи C-C — это галогенирование
и нитрирование. Ниже даны примеры реакций метана.
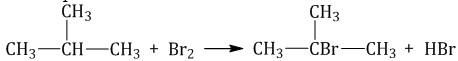
Галогенирование
Реакция галогенирования проходит при температуре 300-400°C или под воздействием ультрафиолетовых лучей.
В процессе реакции образуются галогеноалканы. Чаще всего встречаются реакции с хромом и бромом,
реакции со фтором опасны из-за возможности взрыва, с йодом реакция не проходит.
Процесс галогенирования состоит из трёх этапов: инициирование, рост цепи и обрыв цепи.
Горение
Основное применение алканов — это топливо, поэтому реакцию горения можно назвать самой популярной для
предельных углеводородов. В реакции горения алканы превращаются в воду и углекислый газ. Реакция
горения является экзотермической и требует большого количества энергии, например, искра или огонь.
Общая реакция горения алканов:
Реакция горения метана
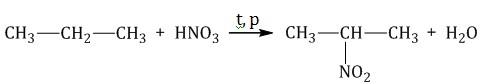
Нитрирование
При температуре 140°C, при повышении давления, алканы реагируют с азотной кислотой, атом водорода
замещается на остаток азотной кислоты NO2, продукты реакции называются нитросоединениями:
Синтез
Синтез Вюрца
В 1855 году Адольф Вюрц открыл, что в реакции металлического натрия с галогеноалканом образуется
соль натрия:
Свободные радикалы галогеноалкана реагируют друг с другом, образуя более длинные соединения.
Общее уравнение реакции имеет вид:
Восстановление галогеналкилов
Большинство галогеналкилов в реакции с цинком и катионами водорода (или кислотой Брёнстеда-Лоури) образуют алканы. В такой реакции, цинк является
восстановителем и позволяет заменить галоген на водород:
Реактивы Гриньярда
Реактивы Гриньярда — это органические соединения, в которых присутствует связь металл-углерод. Такие реактивы
образуются в результате реакции галогеналкила с магнием в растворе диэтилового эфира:
Реакция также проходит с хлоридами, бромидами и иодидами алкилов. В процессе гидролиза, реактивы Гриньярда
преобразовываются в алканы:
Алканы получают либо с помощью синтеза, либо из природных источников (природный газ, нефть, уголь). Применение
насыщенных углеводородов очень обширно, алканы используются в качестве газового, бензинового, дизельного и
ракетного топлива. Вазелин, растворители и парафин — также заслуга алканов.
Физические свойства
Г а з о п о д и б н а. способны с водой образовывать, особенно под давлением, молекулярные соединения — газогидраты, для которых температура разложения при давления 0,1 МПа и критическая температура соответственно равны: с метаном — 29 и 21,50 ? C, с этаном — 15,8 и 14,50 ? C, с пропаном 0 и 8,50 ? C. Такие гидраты часто вымерзают на внутренних стенках газопроводов. Гидраты — соединения, включения (клатраты) — представляют собой снигоподибни вещества, с общей формулой М n Н 2 О, где значение n изменяется от 5,75 до 17 в зависимости от состава газа и условий образования. Природные газы содержат в основном метан и менее 20% в сумме этана, пропана и бутана, примеси легкокиплячих жидких углеводородов — пентана, гексана и других. Кроме этого присутствуют в малом количестве оксид углерода (IV), азот, сероводород и инертные газы.
Р и д к а., Особенно нормального строения, могут в сравнительно мягких условиях окиснюватися кислородом воздуха. Они являются компонентами моторного топлива: бензина, газотурбинных (авиационных, наземных, морских) и дизельных.
Т в е р д а. выделяются из нефтяного сырья при производстве смазочных масел, поскольку они выкристаллизовываются елея, уменьшая подвижность и вызывая застывания при высоких температурах. Твердые алканы делятся на две группы веществ — собственно парафин и церезин.
До насыщенных углеводородов относятся метан CH 4,этан C 2 H 6пропан C 3 H 8,бутан C 4 H 10 и многие другие, которые по своим химическим свойствам подобные метана. Легкие алканы, например, метан, этан, пропан и бутан — это бесцветные газы; более тяжелые — жидкости или твердые вещества. В природе они встречаются в природном газе и нефти. Поскольку алканы имеют только один ковалентная связь, они называются насыщенными.
Если формулы насыщенных углеводородов написать в ряд по возрастанию атомов углерода, то получим так называемый гомологический ряд насыщенных углеводородов, или углеводородов ряда метана. В этом ряду каждый последующий углеводород отличается от предыдущего наличием в составе молекулы одной и той же группы атомов CH 2.
Химический состав насыщенных углеводородов можно выразить одной общей формулой C n H 2n +2, где n — число атомов углерода, а 2n +2 — число атомов водорода. Названия насыщенных углеводородов имеют окончание-ан. Эти названия, за исключением первых четырех гомологов, состоящие из греческих названий числительных, которые показывают количество атомов углерода в молекуле углеводорода, и окончания-ан.
| Название углеводорода | Формула | Агрегатное состояние при обычной температуре | Температура плавления | Температура кипения | Плотность |
|---|---|---|---|---|---|
| Метан | СН 4 | Газ | -184 | -164 | 0,717 |
| Этан | С 2 Н 6 | Газ | -182,8 | -88,7 | 1,357 |
| Пропан | С 3 Н 8 | Газ | -187,6 | -42,1 | 2,014 |
| Бутан | С 4 Н 10 | Газ | -138,4 | -0,6 | 0,600 |
| Пентан | С 5 Н 12 | Жидкость | -130 | 36,3 | 0,626 |
| Гексан | С 6 н 14 | Жидкость | -95 | 68,7 | 0,660 |
| Гептан | С 7 н 16 | Жидкость | -91 | 98,4 | 0,684 |
| Октан | С 8 н 18 | Жидкость | -56,5 | 125,7 | 0,703 |
| Нонана | С 9 Н 20 | Жидкость | -53,7 | 150,7 | 0,718 |
| Декан | С 10 н 22 | Жидкость | -30 | 174 | 0,730 |
| Ундекан | С 11 Н 24 | Жидкость | -26,5 | 195 | — |
| Додекане | С 12 н 26 | Жидкость | -12 | 215 | — |
| Тридекан | С 13 Н 28 | Жидкость | -6,2 | 234 | — |
| Тетрадеканом | С 14 Н 30 | Жидкость | +5 | 252 | — |
| Пентадекан | С 15 Н 32 | Жидкость | 10 | 270 | — |
| Гексадекан ( цетан) | С 16 Н 34 | Твердое вещество | 18,17 | 286,79 | 0,773 |
| Гептадекан | С 17 Н 36 | Твердое вещество | 22,5 | 303 | — |
| Октадекан | С 18 Н 38 | Твердое вещество | 28 | 317 | — |
| Нонадекан | С 19 Н 40 | Твердое вещество | 32 | 330 | — |
| Ейкозан | С 20 н 42 | Твердое вещество | 37 | 208 * | — |
| Генейкозан | С 21 н 44 | Твердое вещество | 40,4 | 219 * | — |
| Докозан | С 22 Н 46 | Твердое вещество | 44,4 | 230 * | — |
| Трикозан | С 23 Н 48 | Твердое вещество | 47,7 | 240 * | — |
| Тетракозан | С 24 н 50 | Твердое вещество | 51,1 | 250 * | — |
| Пентакозан | С 25 Н 52 | Твердое вещество | 54 | 259 * | — |
| Гентриаконтан | С 31 н 64 | Твердое вещество | 68 | 312 * | — |
| Дотриаконтан | С 32 Н 66 | Твердое вещество | 70 | 320 * | — |
* При давлении 15 мм
Физические свойства предельных углеводородов закономерно изменяются в зависимости от их состава. Как видно из таблицы, первые четыре гомологи (от C1 до C4) при обычной температуре являются газами, следующие одиннадцать (от C6 до C15) — жидкости, а начиная с гексадекан C 16 H 34 — твердые вещества. С увеличением молекулярной массы их точки плавления и точки кипения постепенно повышаются, а также увеличивается и их плотность. В воде насыщенные углеводороды практически нерастворимые, но хорошо растворяются во многих органических растворителях.
Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
|
Например.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
|
Например.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.

Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: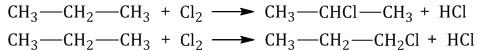 |
Бромирование протекает более медленно и избирательно.
|
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–Н |
|
Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан:
|
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
|
Например. При нитровании пропана образуется преимущественно 2-нитропропан:
|