Гост 61-75 (ст сэв 5375-85) реактивы. кислота уксусная. технические условия (с изменениями n 1, 2, 3)
Содержание:
- Интересные факты
- Использование для здоровья и красоты
- Дополнительная информация:
- Плотность жидких веществ и водных растворов в зависимости от температуры
- Применение
- Что такое ледяная уксусная кислота
- Получение
- Мерная таблица уксуса в граммах и миллилитрах «Сколько уксуса в ложке столовой и чайной»
- Использование в производстве
- Немного истории
- Получение
- История уксуса
- Примечания
- Метод получения 1.
- Обычный столовый уксус: свойства
- Как разводить уксусную эссенцию?
Интересные факты
Ученые физиологии выяснили, что человеку вовсе не обязателен прием уксусной кислоты — без пищевых добавок можно обойтись. Зато людям с непереносимостью кислоты, а также с проблемами желудка, вещество противопоказано.

Уксусная кислота используется в книгопечатании.
Вещество в небольшом количестве было найдено в меде, бананах и пшенице.
Охладив уксусную кислоту и резко взболтав с ней емкость, можно наблюдать ее резкое застывание.
Небольшая концентрация уксусной кислоты может снизить болевой симптом от укуса насекомых, а также мелких ожогов.
Прием в пищу продуктов с малым содержанием уксусной кислоты снижает уровень холестерина в организме. Вещество хорошо стабилизирует уровень сахара у диабетиков.
Употребление белковой и углеводной пищи вместе с небольшим количеством уксусной кислоты повышает их усвояемость организмом.
Если еда пересолена, достаточно добавить пару капель уксуса, чтобы сгладить солоноватость.
Использование для здоровья и красоты
Гален, римский врач и фармацевт, использовал в работе рецепты настоек на уксусе. На его основе в русских травниках и зельницах (аналогах лекарственных книг) описывались составы растираний, полосканий и примочек.
С давних пор винный уксус употребляли в качестве антисептика, сбивали компрессами на его основе высокую температуру.
Эта специя входит в состав лекарственных средств при кожных воспалениях, грибковых поражениях, при варикозе и ангине, для пилинга лица, антицеллюлитных обертываний.

Благодаря своему богатому составу, винный уксус активизирует обменные процессы в организме, снижает уровень холестерина, укрепляет иммунную систему.
Чаще всего уксусная терапия, как самостоятельное средство, употребляется для профилактики или на начальных стадиях заболевания. Также винный уксус оказывает хорошее целебное действие как вспомогательный компонент к основному лечению.
Дополнительная информация:
Медленно реагирует с водой с образованием уксусной кислоты. С основаниями дает ацетаты, с хлороводородом и фосгеном при 70-80 С — ацетилхлорид, со спиртами — сложные эфиры, с тиолами — тиоэфиры, с аминами — амиды, с альдегидами в присутствии кислых катализаторов — диацетаты, с ароматическими альдегидами в присутствии ацетата калия — бета-арилакриловые кислоты. Ацетилирует целлюлозу, превращает высшие жирные кислоты в ангидриды, алифатические и жирноароматические кетоны в присутствии трифторида бора — в бета-дикетоны.
Входит в список IV (прекурсоры) наркотических и психотропных веществ. Мировое производство 1,1-1,3 млн. тонн (1988 г).
«Химическая энциклопедия» т.3 М.: Советская энциклопедия, 1992 стр. 180
«Химическая энциклопедия» т.5 М.: Советская энциклопедия, 1999 стр. 33
Бабаян Э.А., Гаевский А.В., Бардин Е.В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
Некрасов Б.В. «Основы общей химии» т.1 М.:Химия, 1973 стр. 563
Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 126
Плотность жидких веществ и водных растворов в зависимости от температуры
ГЛАВНАЯ » Cправочник физико-химических величин
Плотность жидкости в зависимости от температуры можно рассчитать по формуле$\rho_{2} = \frac{ \rho_{1} }{1 + \beta(t_{2} — t_{1} )}$, где $\rho_{2}$ – искомая плотность жидкости при температуре $t_{2}$; $\rho_{1}$ – известная плотность жидкости при температуре $t_{1}$; $\beta$ – коэффициент термического объемного расширения жидкости, $К^{-1}$.
| Вещество | -20 ℃ | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ | 120 ℃ |
|---|---|---|---|---|---|---|---|---|
| Азотная кислота ($HNO_{3}$) 100% | 1582 | 1547 | 1513 | 1478 | 1443 | 1408 | 1373 | 1338 |
| Азотная кислота ($HNO_{3}$) 50% | — | 1334 | 1310 | 1278 | 1263 | 1238 | 1212 | 1186 |
| Аммиак жидкий ($HN_{3}$) | 665 | 639 | 610 | 580 | 545 | 510 | 462 | 390 |
| Аммиачная вода ($NH_{3} \cdot H_{2}O$) 25% | — | 918 | 907 | 897 | 887 | 876 | 866 | 856 |
| Анилин ($C_{6}H_{5}NH$) | — | 1039 | 1022 | 1004 | 987 | 969 | 952 | 933 |
| Ацетон ($C_{3}H_{6}O$) | 835 | 813 | 791 | 768 | 746 | 719 | 693 | 665 |
| Бензол ($C_{6}H_{6}O$) | — | 900 | 879 | 858 | 836 | 815 | 793 | 769 |
| Бутиловый спирт ($C_{4}H_{10}O$) | 838 | 824 | 810 | 795 | 781 | 766 | 751 | 735 |
| Вода ($H_{2}O$) | — | 1000 | 998 | 992 | 983 | 972 | 958 | 943 |
| Гексан ($C_{6}H_{14}$) | 693 | 677 | 660 | 641 | 622 | 602 | 581 | 559 |
| Глицерин, ($C_{3}H_{8}O_{3}$), 50% | — | 1136 | 1126 | 1116 | 1106 | 1006 | 996 | 986 |
| Диоксид серы ($SO_{2}$) | 1484 | 1434 | 1383 | 1327 | 1264 | 1193 | 1111 | 1010 |
| Дихлорэтан ($C_{2}H_{4}Cl_{2}$) | 1310 | 1282 | 1254 | 1224 | 1194 | 1163 | 1133 | 1102 |
| Диэтиловый эфир ($(C_{2}H_{5})_{2}O$) | 758 | 736 | 714 | 689 | 666 | 640 | 611 | 576 |
| Изопропиловый спирт ($C_{3}H_{8}O$) | 817 | 801 | 785 | 768 | 752 | 735 | 718 | 700 |
| Кальций хлористый, ($CaCl_{2} \cdot H_{2})$) 25 % | 1248 | 1239 | 1230 | 1220 | 1210 | 1200 | 1190 | 1180 |
| м-Ксилол | — | 882 | 865 | 847 | 831 | 796 | 780 | 764 |
| Метиловый спирт, ($CH_{3}OH$) 100% | 828 | 810 | 792 | 774 | 756 | 736 | 714 | — |
| Метиловый спирт, ($CH_{3}OH$) 40% | — | 946 | 935 | 924 | 913 | 902 | 891 | 880 |
| Муравьиная кислота ($HCOOH$) | — | 1244 | 1220 | 1195 | 1171 | 1147 | 1121 | 1096 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 50% | — | 1540 | 1525 | 1511 | 1497 | 1483 | 1469 | 1454 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 40% | — | 1443 | 1430 | 1416 | 1403 | 1389 | 1375 | 1360 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 20% | — | 1230 | 1219 | 1208 | 1196 | 1183 | 1170 | 1155 |
| Натрий хлористый ($NaCl \cdot H_{2}O$), 20% | — | 1157 | 1148 | 1189 | 1130 | 1120 | 1110 | 1100 |
| Натрий хлористый ($C_{6}H_{5}HO_{2}$) | — | 1223 | 1203 | 1183 | 1163 | 1143 | 1123 | 1103 |
| Октан ($C_{8}H_{18}$) | 734 | 718 | 702 | 686 | 669 | 653 | 635 | 617 |
| Олеум ($C_{8}H_{18}$), 20% | — | 1922 | 1896 | 1870 | 1844 | 1818 | 1792 | 1766 |
| Пропиловый спирт ($C_{3}H_{8}O$), 20% | — | 819 | 804 | 788 | 770 | 752 | 733 | 711 |
| Серная кислота ($H_{2}SO_{4}$), 98% | — | 1857 | 1837 | 1817 | 1798 | 1779 | 1761 | 1742 |
| Серная кислота ($H_{2}SO_{4}$), 92% | 1866 | 1845 | 1824 | 1803 | 1783 | 1765 | 1744 | 1723 |
| Серная кислота ($H_{2}SO_{4}$), 75% | 1709 | 1689 | 1669 | 1650 | 1632 | 1614 | 1597 | 1580 |
| Серная кислота ($H_{2}SO_{4}$), 60% | 1532 | 1515 | 1498 | 1482 | 1466 | 1450 | 1434 | 1418 |
| Сероуглерод ($CS_{2}$) | 1323 | 1293 | 1263 | 1233 | 1200 | 1165 | 1125 | 1082 |
| Соляная кислота, ($HCl \cdot H_{2}O$) 30% | 1173 | 1161 | 1149 | 1138 | 1126 | 1115 | 1103 | 1090 |
| Толуол, ($C_{7}H_{8}$) | 902 | 884 | 866 | 847 | 828 | 808 | 788 | 766 |
| Уксусная кислота, ($CH_{3}COOH$) 100% | — | 1072 | 1048 | 1027 | 1004 | 981 | 958 | 922 |
| Уксусная кислота, ($CH_{3}COOH$) 50% | — | 1074 | 1058 | 1042 | 1026 | 1010 | 994 | 978 |
| Фенол (расплавленный) | — | — | 1075 | 1058 | 1040 | 1022 | 1003 | 987 |
| Хлорбензол ($C_{6}H_{5}Cl$) | 1150 | 1128 | 1107 | 1085 | 1065 | 1041 | 1021 | 995 |
| Хлороформ ($CHCl_{3}$) | 1563 | 1526 | 1489 | 1450 | 1411 | 1380 | 1326 | 1280 |
| Четыреххлористый углерод, фреон-10, хладон-10 ($CCl_{4}$) | 1670 | 1633 | 1594 | 1556 | 1517 | 1471 | 1434 | 1390 |
| Этилацетат, этиловый эфир уксусной кислоты ($С_{4}H_{8}O_{2}$) | 947 | 924 | 901 | 876 | 851 | 825 | 797 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH$) 100% | 823 | 806 | 789 | 772 | 754 | 735 | 716 | 693 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 80% | — | 857 | 843 | 828 | 813 | 797 | 783 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 60% | — | 904 | 891 | 878 | 864 | 849 | 835 | 820 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 40% | — | 947 | 935 | 923 | 910 | 897 | 885 | 872 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 20% | — | 977 | 969 | 957 | 946 | 934 | 922 | 910 |
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн, в 2014 год — около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умертвления насекомых[источник не указан 957 дней]. Насекомые после умертвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира::
- 2CH3COOC2H5→CH3COCH2COOC2H5+C2H5OH{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}+C_{2}H_{5}OH}}}
Что такое ледяная уксусная кислота
Ледяная уксусная кислота (ЛУК) представляет собой органическое соединение, одноосновную кислоту, относящуюся к классу карбоновых кислот.
Это регулятор кислотности, стабилизатор, зарегистрированная официально пищевая добавка Е260, нормы — ГОСТ 61-75.
Области применения:
- производство кондитерских изделий;
- изготовление консервов;
- промышленность;
- фармацевтика;
- парфюмерия.
Хранить дома жидкую ледяную кислоту опасно, так как даже небольшое ее количество при неосторожном применении может вызвать летальный исход
Формула
Синонимы ледяной уксусной кислоты (формула СН3СООН или С2Н4О2) — этановая кислота, уксусная кислота, ЛУК. Acetic acid glaciad — международное название. Это эффективный растворитель органических соединений, который прекрасно смешивается с большинством растворителей, гигроскопична, хорошо растворяется в воде.
Квалификация вещества — «хч», то есть химически чистый (высшая степень чистоты реактива, то есть основной компонент содержится в количестве 99% и более).
ЛУК можно приобрести в аптеке без рецепта в виде:
- субстанции ледяной 1 кг или 1 г;
- субстанции 1 кг.
Получение
Вещество получают микробиологическим (брожение содержащих спирт жидкостей) или химическим (перегонка древесины) способами.
ЛУК получают следующими способами:
- Окисление нефтепродуктов — эффективнейший и самый недорогой из существующих методов.
- Уксуснокислое брожение. При этом как сырье используются жидкости, в составе которых имеется этанол (соки, вино) и кислород с участием ферментов грибков или бактерий.
- Из оксида углерода и ментола (при промышленном производстве).
- Реакция Эмануэля. Суть методики — окисление н-бутана с участием кобальтового катализатора, температуры +200 градусов Цельсия и давления 50 атмосфер.
Свойства уксусной кислоты напрямую зависят от ее концентрации, то есть от содержания воды или примесей.

Концентрация
Применяется в быту и пищевой промышленности как эссенция или уксус. Объясняется подобное легкостью разбавления вещества то нужной концентрации при знании правильных пропорций.
Названия кислоты разные и зависят от концентрации основного вещества:
- уксус — содержит от 3 до 15%;
- эссенция — от 70 до 80%;
- ледяная — является химически чистой (без примесей) или содержит как минимум 96% уксусной кислоты.
Свойства
Ледяная кислота представляет собой кристаллы или жидкость без цвета, имеет очень резкий запах, на вкус кислая. Закипает при температуре +118,1 градуса Цельсия, плавится (то есть кристаллы становятся жидкостью) при +16,75 градуса Цельсия. Очень высокая температура обуславливает самовозгорание ЛУК.
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
-
- CH3COOH+C2H5OH→CH3COOC2H5+H2O{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+H_{2}O}}}
Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
-
- CH3COCl+C2H5OH→CH3COOC2H5+HCl{\displaystyle {\mathsf {CH_{3}COCl+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+HCl}}}
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработка этилового спирта кетеном.
- Дегидратация этилового спирта при повышенных температурах и давлении.
- Синтез по реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
- 2CH3CHO→CH3COOC2H5{\displaystyle {\mathsf {2CH_{3}CHO\rightarrow CH_{3}COOC_{2}H_{5}}}}
Мерная таблица уксуса в граммах и миллилитрах «Сколько уксуса в ложке столовой и чайной»
| Это сколько столовых ложек? | Столовых ложек | Десертных ложек | Чайных ложек |
|---|---|---|---|
| 200 грамм (мл.) уксуса | 13 | 1 | |
| 200 грамм (мл.) уксуса | 20 | ||
| 150 грамм (мл.) уксуса | 10 | ||
| 150 грамм (мл.) уксуса | 15 | ||
| 100 грамм (мл.) уксуса | 6 | 1 | |
| 100 грамм (мл.) уксуса | 6 | 2 | |
| 100 грамм (мл.) уксуса | 10 | ||
| 100 грамм (мл.) уксуса | 20 | ||
| 90 грамм (мл.) уксуса | 6 | ||
| 80 грамм (мл.) уксуса | 5 | 1 | |
| 75 грамм (мл.) уксуса | 5 | ||
| 70 грамм (мл.) уксуса | 4 | 2 | |
| 70 грамм (мл.) уксуса | 4 | 1 | |
| 65 грамм (мл.) уксуса | 4 | 1 | |
| 60 грамм (мл.) уксуса | 4 | ||
| 50 грамм (мл.) уксуса | 3 | 1 | |
| 45 грамм (мл.) уксуса | 3 | ||
| 40 грамм (мл.) уксуса | 2 | 2 | |
| 40 грамм (мл.) уксуса | 4 | ||
| 40 грамм (мл.) уксуса | 8 | ||
| 35 грамм (мл.) уксуса | 2 | 1 | |
| 30 грамм (мл.) уксуса | 2 | ||
| 30 грамм (мл.) уксуса | 3 | ||
| 30 грамм (мл.) уксуса | 6 | ||
| 25 грамм (мл.) уксуса | 5 | ||
| 20 грамм (мл.) уксуса | 1 | 1 | |
| 20 грамм (мл.) уксуса | 2 | ||
| 20 грамм (мл.) уксуса | 4 | ||
| 15 грамм (мл.) уксуса | 1 | ||
| 10 грамм (мл.) уксуса | 1 | ||
| 5 грамм (мл.) уксуса | 1 |
Чаще всего в магазинах можно найти столовый уксус или просто уксус. Наиболее популярные из них это 3%, 6% и 9%. Трех и Шести процентный уксус чаще всего используется для салатов. Девяти процентный (9%) уксус принято использовать для маринадов.
Если вам понравилась наша мерная таблица уксуса, посмотрите пожалуйста нашу самую полную мерную таблицу продуктов питания.
Использование в производстве
В соединениях солей и других сложных веществ уксусная кислота выступает незаменимым элементом:
- Фармацевтическая отрасль. Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина.
- Производство синтетических волокон. Негорючие пленки, ацетилцеллюлоза.
- Пищевая отрасль. Для успешной консервации, приготовления маринадов и соусов, в качестве пищевой добавки E260.
- Текстильная отрасль. Входит в состав красителей.
- Производство косметики и средств гигиены. Ароматические масла, крема для улучшения тонуса кожи.
- Изготовление протрав. Используется как инсектицид и протрава от сорняков.
- Производство лаков. Технические растворители, производство ацетона.

Ежегодно производство уксусной кислоты увеличивается. На сегодня его объем в мире составляет более 400 тысяч тонн в месяц. Транспортировка кислоты осуществляется в прочных цистернах из стали. Хранение в пластиковой таре на многих производствах в связи с высокой физической и химической активностью уксусной кислоты запрещено либо ограничено сроком до нескольких месяцев.
Немного истории
Открытие уксуса было одним из первых в ряду кислот и совершалось поэтапно. Вначале уксусную кислоту стали добывать путем перегонки арабские ученые 8-го века. Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как «кислый». В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Вплоть до 19-го века ученые находили присутствие уксусной кислоты только в органическом виде — как часть соединений солей и эфиров. В составе растений и их плодов: яблок, винограда. В организме людей и животных: потовые выделения, желчь. В начале 20-го века русские ученые случайным образом добыли уксусный альдегид из реакции ацетилена с окисью ртути. На сегодня потребление уксусной кислоты на столько велико, что ее основная добыча происходит только синтетическим способом в огромных масштабах.
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца(II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
- 2CH3CHO+O2⟶2CH3COOH{\displaystyle {\mathsf {2CH_{3}CHO+O_{2}\longrightarrow 2CH_{3}COOH}}}
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
- 2C4H10+5O2⟶4CH3COOH+2H2O{\displaystyle {\mathsf {2C_{4}H_{10}+5O_{2}\longrightarrow 4CH_{3}COOH+2H_{2}O}}}
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
Каталитическое карбонилирование метанола
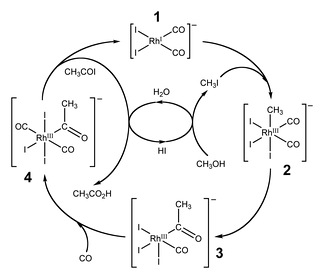
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
- CH3OH+CO⟶CH3COOH{\displaystyle {\mathsf {CH_{3}OH+CO\longrightarrow CH_{3}COOH}}}
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов
Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO)
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
-
- CH3CH2OH+O2→CH3COOH+H2O{\displaystyle {\mathsf {CH_{3}CH_{2}OH+O_{2}\rightarrow CH_{3}COOH+H_{2}O}}}
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути
-
- C2H2+H2O→Hg2+CH3CHO{\displaystyle {\mathsf {C_{2}H_{2}+H_{2}O{\xrightarrow{Hg^{2+}}}CH_{3}CHO}}} — Реакция Кучерова
-
- CH3CHO→CrO3,H2SO4CH3COOH{\displaystyle {\mathsf {CH_{3}CHO{\xrightarrow{CrO_{3},H_{2}SO_{4}}}CH_{3}COOH}}}
История уксуса
Уксус является продуктом, который известен человечеству уже более 7000лет.
Гиппократ описывал его использование в качестве внутреннего и наружного средства.
Уксус являлся важным консервантом и пряностью. В древних писаниях он упоминается как безалкогольный напиток для путешествий, охоты и работы.
В течение многих веков раствор уксусной кислоты использовался в качестве дезинфицирующего средства. Например, во время смертельных эпидемий чумы им пропитывались защитные маски.
Получение уксуса в древности, вероятно явилось следствием случайного открытия при ферментации виноградного сока в вино.
При алкогольной ферментации дрожжи превращают сахар в этанол и углекислый газ. При этом емкости для брожения должны быть надежно защищены от попадания воздуха. Иначе бактерии уксусной кислоты, в присутствии кислорода, могут ферментативно окислить этанол до уксусной кислоты, и вино приобретет кислый вкус.
Однако, при природном (естественном) ферментативном окислении можно получить максимальную концентрацию не более 15% уксусной кислоты, поскольку ферменты неэффективны при более высоких концентрациях. Они практически убивают сами себя.
Существует много разных сортов уксуса, которые отличаются не только концентрацией, но и вкусом. Однако, основным компонентом у них всегда будет вода и уксусная кислота (этановая кислота).
Примечания
- ↑
- CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31.
- ↑
- ↑ Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- Б. Лич. Катализ в промышленности. Том 1. — Москва: Мир, 1986. — 324 с.
- Кандидат биологических наук Н. Кустова. (недоступная ссылка). Интернет-ресурс «Всякая всячина». Дата обращения 2 сентября 2010.
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 15—18. — 2 350 000 экз.
- Уксус — статья из Большой советской энциклопедии.
- (недоступная ссылка). Дата обращения 16 мая 2011.
Метод получения 1.
органической химии
К 80 г тонкоизмельченного безводного уксуснокислого натрия прибавляют по каплям из капельной воронки 54 г (0,75 моля) хлористого ацетила. После прибавления примерно половинного количества хлорангидрида реакцию прерывают на короткое время и перемешивают кашицеобразную массу стеклянной палочкой, несколько согнутой и сплющенной на конце. Только после этого прибавляют остаток хлористого ацетила; прибавление его ведут настолько медленно, чтобы не вошедший в реакцию хлористый ацетил не отгонялся.
По окончании реакции отгоняют полученный ангидрид от избытка соли, нагревая колбу коптящим пламенем (непрерывно обводят им колбу). Дестиллат подвергают фракционированной перегонке, прибавляя к нему 3 г тонкоизмельченного безводного уксуснокислого натрия, чтобы полностью перевести остатки хлористого ацетила в уксусный ангидрид.
Температура кипения чистого уксусного ангидрида 138°. Выход 55—60 г.
Обычный столовый уксус: свойства
Этот продукт известен человечеству с глубокой древности. Применялся он не только в кулинарии, но и в хозяйстве, и в медицине, и в косметологии. Такой широкий спектр применения объясняется особенными свойствами жидкости.
Существует два вида уксуса — натуральный и синтетический. Первый получают путём брожения спиртовых дрожжей. В его состав входит множество полезных веществ. Именно такой вид используют в кулинарии, медицине и косметологии. Жидкость, полученную искусственным способом, чаще применяют в хозяйственных целях. Можно также использовать вместо неё уксусную кислоту.
Синтетический уксус обладает рядом свойств, которые делают его очень ценным для всех хозяек:
- Отбеливающее. Благодаря содержанию кислот, это вещество возвращает вещам первоначальную белизну, эффективно избавляя от желтизны и серого оттенка. С помощью этого средства можно отбеливать даже деликатные ткани.
- Нейтрализующее запахи. Данный продукт прекрасно справляется с устойчивыми ароматами, например, после рыбы, чеснока, лука, поэтому рекомендуется для стирки кухонных полотенец.
- Антисептическое. Уксус прекрасно обеззараживает поверхности, уничтожая колоны болезнетворных бактерий.
- Смягчающее. Поскольку продукт обладает кислой реакцией, он эффективно смягчает жёсткую воду, что способствует смягчению тканей, которые в ней стираются.
- Противогрибковое. Средство уничтожает споры грибка, поэтому его рекомендуется применять для очистки постельного белья и другого домашнего текстиля.

Сода и уксус — самые простые помощники по наведению чистоты в доме
Уксус часто добавляют в воду для мытья окон, чтобы придать стёклам сияющий блеск. Он эффективно устраняет известковый налёт в чайнике, прекрасно справляется с таковым в стиральной машине, поэтому ответ на вопрос, можно ли при стирке добавлять уксус, является утвердительным: он будет ухаживать за деталями машины не хуже разрекламированного Калгона. Более того, он будет защищать силиконовые детали машины от плесневого грибка.
Как разводить уксусную эссенцию?
Как следствие многих интересует, как разводить уксусную эссенцию в домашних условиях. Ведь не всегда есть возможность купить нужный продукт в магазине, а хранить весь ассортимент дома накладно, да и места на кухне недостаточно. Главное, что нужно знать — это пропорции уксусной эссенции и воды для получения нужного раствора. Например, чтобы сделать 9% столовый уксус, нужно смешать эссенцию и воду в соотношении 1 к 7. Чтобы каждый раз не искать эту информацию, можно иметь под рукой подобную таблицу.
| Процент уксуса, % | Количество эссенции, ст. ложки | Вода, ст. ложки |
| 3 | 2 | 45 |
| 5 | 1 | 13 |
| 7 | 1 | 9 |
| 10 | 1 | 6 |
| 30 | 2 | 3 |