Химические формулы для «чайников»
Содержание:
Применение алканов.
Алканы в составе бензина, керосина, солярового масла, мазута используются в качестве топлива. Высшие алканы входят в состав смазочных масел, вазелина и парафина. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров (капрон, найлон). Циклопропан используется для наркоза. Сквалан – высококачественное смазочное масло, компонент фармацевтических и косметических препаратов, адсорбент в газожидкостной хроматографии.
Алканы служат сырьем для получения многих органических соединений, в том числе спиртов, альдегидов, кислот. Хлорпроизводные алканов используют как растворители, например, трихлорметан (хлороформ) CHCl3, тетрахлорметан CCl4. Смесь высших алканов – парафин нетоксичен и широко применяется в пищевой промышленности для пропитки тары и упаковочных материалов (например, пакетов для молока), при производстве жевательных резинок. Парафином пропитывают карандаши, верхнюю (вблизи головки) часть спичек для их лучшего горения. Разогретый парафин используют в лечебных целях (парафинолечение). Окисление парафина в контролируемых условиях в присутствии катализаторов (органические соли переходных металлов) приводит к получению кислородсодержащих продуктов, главным образом, органических кислот.
Илья Леенсон
Токсические свойства
Фенол — токсичное вещество. По степени воздействия на человеческий организм фенол относится к высокоопасным веществам (Класс опасности 2). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
- ПДКр.з. = 1 мг/м³ (2 класс опасности)
- ПДКр.с. = 0,3 мг/м³ (2 класс опасности)
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,006 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
Охрана труда
При ПДК в воздухе рабочей зоны 1 мг/м³ (максимально-разовая) и 0,3 мг/м³ (среднесменная). Порог восприятия запаха фенола у разных людей разный; и он может достигать (среднее значение в группе) 5,8-7,5 мг/м³. А у отдельных работников он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых в сочетании с «заменой по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров фенола на, по крайней мере, часть работников, и причинить вред их здоровью — из-за запоздалой замены противогазных фильтров. Для защиты от фенола следует использовать более эффективные изменение технологии и средства коллективной защиты.
Наглядным примером воздействия фенола на окружающую среду стал случай весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз. Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Население Уфы было оповещено об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек.
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы.
В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. В чистом виде фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Классификация простых соединений
Теперь пришло время ознакомиться с самым интересным: классификацией как органических, так и неорганических веществ.
Сейчас миру известны тысячи различных неорганических соединений. Знать все их названия, формулы и свойства практически невозможно. Поэтому все вещества неорганической химии разделены на классы, группирующие все соединения по сходному строению и свойствам. Такая классификация представлена в таблице ниже.
| Неорганические вещества | |
| Простые | Металлические (металлы) |
| Неметаллические (неметаллы) | |
| Амфотерные (амфигены) | |
| Благородные газы (аэрогены) | |
| Сложные | Оксиды |
| Гидроксиды (основания) | |
| Соли | |
| Бинарные соединения | |
| Кислоты |
Для первого разделения использовалось то, из скольких элементов состоит вещество. Если из атомов одного элемента, то оно простое, а если из двух и более — сложное.
Рассмотрим каждый класс простых веществ:
- Металлами называют элементы, расположенные в первой, второй, третьей группах (кроме бора) периодической таблицы Д. И. Менделеева, а также элементы декад, лантоноиды и октиноиды. Все металлы обладают общими физическими (ковкостью, тепло- и электропроводностью, металлическим блеском) и химическими (восстановительные, взаимодействие с водой, кислотой и так далее) свойствами.
- К неметаллам относят все элементы восьмой, седьмой, шестой (кроме полония) групп, а также мышьяк, фосфор, углерод (из пятой группы), кремний, углерод (из четвертой группы) и бор (из третьей).
- Амфотерные соединения — это такие соединения, которые могут проявлять свойства как неметаллов, так и металлов. Например, алюминий, цинк, бериллий и так далее.
- К благородным (инертным) газам относятся элементы восьмой группы: радон, ксеон, криптон, аргон, неон, гелий. Их общее свойство — малая активность.
Так как все простые вещества состоят из атомов одного и того же элемента Периодической системы, то их названия обычно совпадают с названиями этих химических элементов таблицы.
Чтобы различать понятия «химический элемент» и «простое вещество», несмотря на схожесть названий, нужно понимать следующее: при помощи первого образуется сложное вещество, оно связывается с атомами других элементов, его нельзя рассматривать отдельно от какого-либо сложного вещества. Второе же понятие дает нам знать, что это вещество имеет свои свойства, не связываясь с другими. Например, есть кислород, входящий в состав воды, а есть кислород, которым мы дышим. В первом случае элемент как часть целого — воды, а во втором — как само по себе вещество, которым дышит организм живых существ.
Теперь рассмотрим каждый класс сложных веществ:
- Оксидами называется сложное вещество, состоящее из двух элементов, одним из которых является кислород. Оксиды бывают: основными (при растворении в воде из них образуются в основания), амфотерными (образованы при помощи амфотерных металлов), кислотными (образованы неметаллами в степенях окисления от +4 до +7), двойные (образованы с участием металлов в разных окислительных степенях) и несолеобразующие (например, NO, CO, N2O и другие).
- К гидроксидам относят вещества, имеющие в своем составе группу — OH (гидроксильную группу). Они бывают: основными, амфотерными и кислотными.
- Солями называются такие сложные соединения, в состав которых входит катион металла и анион кислотного остатка. Соли бывают: средними (катион металла + анион кислотного остатка); кислыми (катион металла + незамещенный(ые) атом(ы) водорода + кислотный остаток); основными (катион металла + кислотный остаток + гидроксильная группа); двойными (два катиона металла + кислотный остаток); смешанными (катион металла + два кислотных остатка).
- Бинарное соединение представляет собой двухэлементное соединение или многоэлементное, включающее не более одного катиона, или аниона, или сложного катиона, или аниона. Например, KF, CCl4, NH3 и так далее.
- К кислотам относятся такие сложные вещества, катионами которых являются исключительно ионы водорода. Их отрицательные анионы называются кислотными остатками. Данные сложные соединения могут быть кислородосодержащими или бескислородными, одноосновными или двуосновными (в зависимости от числа атомов водорода), сильными или слабыми.
Гомологический ряд
Первый представитель – метан, поэтому алканы также называют гомологическим рядом метана. В таблице алканов указаны первые 20 представителей.
|
Название |
Формула |
Название |
Формула |
|
Метан |
CH4 |
Ундекан |
C11H24 |
|
Этан |
C2H6 |
Додекан |
C12H26 |
|
Пропан |
C3H8 |
Тридекан |
C13H28 |
|
Бутан |
C4H10 |
Тетрадекан |
C14H30 |
|
Пентан |
C5H12 |
Пентадекан |
C15H32 |
|
Гексан |
C6H14 |
Гексадекан |
C16H34 |
|
Гептан |
C7H16 |
Гептадекан |
C17H36 |
|
Октан |
C8H18 |
Октадекан |
C18H38 |
|
Нонан |
C9H20 |
Нанадекан |
C19H40 |
|
Декан |
C10H22 |
Эйкозан |
C20H42 |
Начиная с бутана, все алканы имеют структурные изомеры. К названию прибавляется приставка изо-: изобутан, изопентан, изогексан.
Рис. 2. Примеры изомеров.
Нахождение в природе и получение.
Основные источники алканов – нефть и природный газ. Метан составляет основную массу природного газа, в нем присутствуют также в небольших количествах этан, пропан и бутан. Метан содержится в выделениях болот и угольных пластов. Наряду с легкими гомологами метан присутствует в попутных нефтяных газах. Эти газы растворены в нефти под давлением и находятся также над ней. Алканы составляют значительную часть продуктов переработки нефти. Содержатся в нефти и циклоалканы – они называются нафтенами (от греч. naphtha – нефть). В природе широко распространены также газовые гидраты алканов, в основном метана, они залегают в осадочных породах на материках и на дне океанов. Их запасы, вероятно, превышают известные запасы природного газа и в будущем могут случить источником метана и его ближайших гомологов.
Алканы получают и пиролизом (коксованием) каменного угля и его гидрирования (получение синтетического жидкого топлива). Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев, цветов и семян растений, входят в состав пчелиного воска.
В промышленности алканы получают каталитическим гидрированием оксидов углерода СО и СО2 (метод Фишера – Тропша). В лаборатории метан можно получить нагреванием ацетата натрия с твердой щелочью: CH3COONa + NaOH CH4 + Na2CO3, а также гидролизом некоторых карбидов: Al4C3 + 12H2O 3CH4 + 4Al(OH)3. Гомологи метана можно получить по реакции Вюрца, например: 2CH3Br + 2Na CH3–CH3 + 2NaBr. В случае дигалогеналканов получаются циклоалканы, например: Br–CH2–(CH2)4–CH2Br + 2Na цикло-C6H12 + 2NaBr. Алканы образуются также при декарбоксилировании карбоновых кислот и при электролизе их.
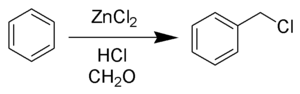
Получение
В промышленности бензилхлорид получают жидкофазным радикальным хлорированием толуола:
-
-
-
- C6H5CH3+Cl2⟶C6H5CH2Cl+HCl{\displaystyle {\ce {C6H5CH3 + Cl2 -> C6H5CH2Cl + HCl}}}
-
-
Таким способом получают около 100,000 тонн бензилхлорида в год. Побочными продуктами являются бензальхлорид и бензотрихлорид (
C6H6CHCl2{\displaystyle {\ce {C6H6CHCl2}}} и C6H5CCl3{\displaystyle {\ce {C6H5CCl3}}}).
Существует несколько вариантов процесса: хлорирование толуола в присутствии 1 % PCI3 при 90—100 °C, хлорирование при УФ-облучении или в присутствии 2,2′-азо-бис-изобутиронитрила.
Бензилхлорид также может быть получен хлорированием толуола сульфурилхлоридом SO2Cl2, хлорметилирование по Блану бензола:
В лаборатории получают реакцией бензилового спирта с концентрированной соляной кислотой, или прямым хлорированием сухого толуола в газовой фазе сухим хлором при облучении, в качестве облучения удобнее всего использовать энергосберегающее диодное ультрафиолетовое освещение, даже не яркий источник ультрафиолетового света приводит к разрыву связи молекулы Cl2, или потребуется мощная лампа накаливания ~500Вт.
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
C2H4 + 2KMnO4 + 2H2O → CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Что такое Стирол — C8H8?
Стирол представляет собой прозрачную жидкость со специфическим запахом. Химическое название и формула: фенилэтилен — C8Н8. Температура кипения стирола + 145°С, температура замерзания —31°С.
Стирол является сырьем для производства самых разнообразных материалов: полистирольных пластмасс, каучуков, лакокрасочных материалов, клеев, пенопласта, минваты, утеплителей, обоев, линолеума и много другого.
Стирол высокотоксичен. При вдыхании паров наблюдаются головные боли, при длительном воздействии — заболевания печени, почек, нервной и кровяной систем. При работе со стиролом следует защищать кожу рук резиновыми перчатками, а в случае больших концентраций пользоваться противогазом. Стирол относится к третьему классу опасности.
Опасность и вред стирола для человека
Стирол — один из самых опасных и часто встречающихся токсичных компонентов. Это происходит потому что стирол очень прочно вошел в нашу жизнь через всевозможные пластики и строительные материалы. Стирол обладает выраженным токсическим действием— длительное вдыхание паров вызывает расстройство нервной системы, катары дыхательных путей, изменение состава крови и печени, раздражение кожи, раздражение слизистых оболочек, нарушение функций вегетативной системы.
Стирол в быту
Стирол применяют для производства различных полимеров: от эластичной пены до высококачественных технических пластмасс. В основном стирол расходуется на производство полистирола, обладающего высокой химической и водостойкостью, низкой стоимостью, является диэлектриком. Конечные варианты применения стирола: одноразовая посуда, упаковка для электронного оборудования, компоненты автомобильных салонов.
На основе стирола производят полистирол — наиболее распространенный вид пластиков. Полистирол, без преувеличения, встречается нам буквально на каждом шагу. Корпус монитора, на котором вы читаете эту статью, наверняка сделан из полистирола. Коробка системного блока компьютера, кстати, тоже. Его используют при изготовлении кузовов многих современных марок автомобилей, корпусов мобильных телефонов, банального пенопласта и потолочных пенополистироловых плит, в производстве пластиковых ванн и душевых кабин… Если продолжать – список получится внушительный, как минимум на несколько страниц.
Из вспененного полистирола производят огромное количество утеплителей- листовых и трубчатых. Они используются для герметизации, звукоизоляции и утепления полов, труб, бань, потолков и стен в квартирах, многоквартирных домах и коттеджах. Все эти материалы потенциально опасны для человеческого организма, так как могут выделять токсичный стирол
Смертельно опасны и продукты горения таких материалов. При окислении стирола кислородом воздуха образуется бензальдегид и формальдегид. При высоких температурах (от 160°С и выше) пенополистирол подвергается интенсивной термоокислительной деструкции разлагаясь в основном до высокотоксичного стирола, сильнейшим образом отравляя окружающую среду и людей, что и имеет место при пожарах в зданиях, утеплённых полистиролом. Помимо этого, при пожарах он плавится и его сплав горит, а температура горящего сплава полистирола достигает 1100°С, что приводит к разрушению даже мощных металлических конструкций. Именно из-за высокой температуры горения пенополистирола его используют как основной компонент в напалмовых бомбах. В связи с этим МЧС уже несколько лет выступает за запрет использования таких материалов в строительстве.
В целом стирол окружает нас везде. Так при изучении состава бытовых отходов электрических и электронных товаров (по данным о средней склонности к потреблению) наблюдается неоспоримое преобладание стиролов, которые составляют более 60% всего объема материалов. Стиролы побеждают своих конкурентов за счет диверсификации сополимеров и сплавов, что позволяет оптимизировать набор необходимых свойств. При изготовлении корпусов и чехлов, львиная доля приходится на стиролы благодаря их цветовой грамме, блеску, возможности создания прозрачных деталей.