Амины
Содержание:
- Целлюлоза
- Определение формул веществ по массовым долям атомов, входящих в его состав.
- Радикалы
- Электролиз солей карбоновых кислот (электролиз по Кольбе)
- Бензол и скелетные формулы
- Применение и реакции
- Система Хилла
- Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Углеводороды
- Оптическая изомерия
- Номенклатура алканов
- Химические свойства алканов
- Свойства
- Что мы узнали?
- Немного о системе easyChem
- Ссылки
- Химические свойства глюкозы
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
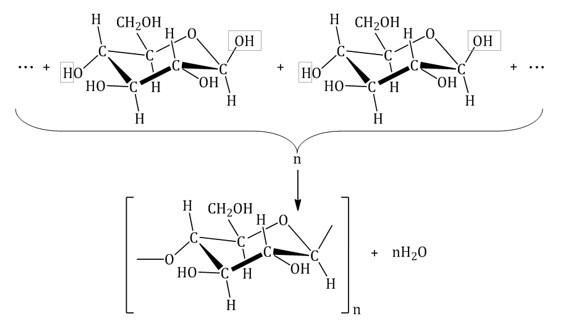
Свойства целлюлозы
Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:

Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.

Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:х : у = n(A) : n(B);
- затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:ν(C) = m / M = 84,21 / 12 = 7,0175 моль,ν(H) = 15,79 / 1 = 15,79 моль.
-
Определяем мольное соотношение атомов С и Н:С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. -
По относительной плотности рассчитаем молярную массу:М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
Радикалы
Радикалы — это ещё одно понятие, которое оказало влияние на химические формулы.
Само слово наверняка всем известно, но в химии радикалы не имеют ничего общего с политиками, бунтовщиками и прочими гражданами с активной позицией.
Здесь это всего лишь фрагменты молекул. И сейчас мы разберёмся, в чём их особенность и познакомимся с новым способом записи химических формул.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты — и
карбоновые кислоты — . Напомню, что -OH и -COOH — это функциональные группы.
А вот R — это и есть радикал. Не зря он изображается в виде буквы R.
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Ну а если отнять два атома водорода, то получится двухвалентный радикал.
Радикалы в химии получили собственные названия.
Некоторые из них получили даже латинские обозначения, похожие на обозначения элементов.
И кроме того, иногда в формулах радикалы могут быть указаны в сокращённом виде, больше напоминающем брутто-формулы.
Всё это демонстрируется в следующей таблице.
| Название | Структурная формула | Обозначение | Краткая формула | Пример спирта |
|---|---|---|---|---|
| Метил | Me | |||
| Этил | Et | |||
| Пропил | Pr | |||
| Изопропил | i-Pr | |||
| Фенил | Ph |
Думаю, что здесь всё понятно
Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Некоторые радикалы записываются в виде, напоминающем брутто-формулу, но функциональная группа записывается отдельно.
Например, превращается в .
А для разветвлённых цепочек вроде изопропила применяются конструкции со скобочками.. Существует ещё такое явление, как свободные радикалы
Это радикалы, которые по каким-то причинам отделились от функциональных групп.
При этом нарушается одно из тех правил, с которых мы начали изучение формул:
число химических связей уже не соответствует валентности одного из атомов. Ну или можно сказать, что одна из связей становится незакрытой с одного конца.
Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Существует ещё такое явление, как свободные радикалы.
Это радикалы, которые по каким-то причинам отделились от функциональных групп.
При этом нарушается одно из тех правил, с которых мы начали изучение формул:
число химических связей уже не соответствует валентности одного из атомов.
Ну или можно сказать, что одна из связей становится незакрытой с одного конца.
Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Это вещество называется бензол. Вот его формулы:
| Развёрнутая формула | Упрощённая формула | Скелетная формула | Брутто-формула |
|---|---|---|---|
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
числа органических веществ.
И вот на примере бензола предлагаю ознакомиться с ещё одним очень важным способом записи структурных формул — скелетными формулами.
Как видно из таблицы, скелетная формула бензола представляет собой правильный шестиугольник без каких-либо букв,
зато изображения химических связей выглядят одинаково.
В общем, правила составления скелетных формул отличаются от уже знакомых нам развёрнутых всего двумя особенностями:
- Буквы C не пишутся. Предполагается, что каждый угол изображаемой геометрической фигуры содержит атом углерода.
- Буквы H тоже не пишутся. Если в углу сходятся меньше четырёх линий, то это означает, что все оставшиеся заняты водородом.
| Вещество | Развёрнутая формула | Скелетная формула | Смешанный вариант | Брутто-формула |
|---|---|---|---|---|
| Нафталин | ||||
| Толуол | ||||
| Кумол |
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет.
Просто иногда внутри одной формулы удобно сочетать различные способы.
коронен
Скелетные формулы существуют не только для циклических молекул.
Понятно, что метан и этан имеют слишком мало узлов, поэтому для них не стоит пытаться использовать скелетные формулы.
А вот какая-нибудь длинная молекула изображается довольно легко.
Только не в виде прямой цепочки, а при помощи ломаной линии, ведь атомы углерода изображаются углами.
| Бутан | Бутен | Изобутан | Гексан |
Применение и реакции
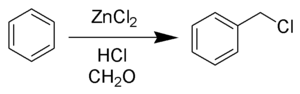
- Бензилхлорид применяют для получения бензилового спирта и особенно бензилцеллюлозы (см. Целлюлоза), широко используемой в производстве пластических масс, плёнок, электроизоляционных покрытий и лаков.
- В промышленности бензилхлорид играет роль прекурсора к бензиловым эфирам, которые используются как пластификаторы, ароматизаторы и парфюмерия.
- Фенилуксусную кислоту, прекурсор к фармацевтическим препаратам, получают через бензилцианид, который образуется при обработке бензилхлорида цианидом натрия.
-
-
-
- C6H5CH2Cl→NaCNC6H5CH2CN→H2OC6H5CH2COOH{\displaystyle {\ce {C6H5CH2Cl -> C6H5CH2CN -> C6H5CH2COOH}}}
-
-
Четвертичные аммониевые соли, используемые в качестве поверхностно-активных веществ, легко образуются алкилированием третичного амина бензилхлоридом:
-
-
-
- R3N+C6H5CH2Cl⟶R3N(C6H5CH2)+Cl−{\displaystyle {\ce {R3N + C6H5CH2Cl -> ^+Cl^-}}}
-
-
В органическом синтезе, бензилхлорид используется для введения бензильной защитной группы, получая соответствующий бензиловый эфир. Снимается данная группа гидрированием на палладии.
-
-
-
- C6H5CH2Cl→ROHC6H5CH2OR→H2PdROH+C6H5CH3{\displaystyle {\ce {C6H5CH2Cl -> C6H5CH2OR -> ROH + C6H5CH3}}}
-
-
- С карбоновыми кислотами, даёт соответствующие бензильные сложные эфиры.
- Бензойная кислота (C6H5COOH) может быть получена окислением бензилхлорида щелочным раствором перманганата калия (KMnO4).
-
-
-
- C6H5CH2Cl→OH−KMnO4C6H5COOH{\displaystyle {\ce {C6H5CH2Cl -> C6H5COOH}}}
-
-
- Он может быть использован в синтезе наркотиков класса амфетаминов, и по этим причинам продажи бензилхлорида находятся под мониторингом в США List II
- Бензилхлорид также легко реагирует с металлическим магнием давая реактив Гриньяра. Он предпочтительнее чем бензил бромид для получения реагента Гриньяра, так как бромид даёт в качестве продукта также продукт сочетания по Вюрцу — 1,2-дифенилэтан.
Бензилирование гетероатомных функциональных групп
Бензилхлорид — удобный бензилирующий агент для гетероатомных функциональных групп и наиболее часто используется для введения этой защитной группы. Бензилирование спиртов этим реагентом достигается в условиях катализа сильным основанием таким как KOH, и в спиртовых растворителях и в условиях фазового переноса с n-Bu4NHSO4 Оксид серебра в ДМФА также эффективенФенолы могут также быть бензилированы в условиях основного катализа
.
Амино группы легко бензилируются при обработке бензилхлоридом в присутствии карбоната или гидроксида при этом дибензилирование является конкурентной реакцией. Тиолы бензилируются в присутствии гидроксида натрия или цезия карбоната и полярных растворителях, таких как этанол или ДМФА.
Амиды могут быть N-бензилированы бензилхлоридом при действии сильных оснований таких как метал гидриды
11
Бензилирование метиленактивных соединений
Анионы и дианионы β-кетоэфиров,, замещённые малоновые эфиры, β-кетоальдегиды, β-дикетоны, β-кетоамиды, и β-кетонитрилы все эффективно реагируют давая С-бензилированные продукты. Когда генерируется дианион из β-кетоамида, β-кетоэфир или β-дикетоне бензилируется менее кислотное положение. Нитрил стабилизированные карбанионы легко бензилируются в эфирных растворителях, аммиаке или ДМСО
Бензилхлорид также реагирует с карбанионами генерированными из кетонов, эфиров, иминов (металлоенаминов) и гидразонов, оксимы.
Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
Но есть ещё один вопрос, который стоит рассмотреть подробнее.
Чем же всё-таки отличаются брутто-формулы от рациональных?
Мы знаем почему рациональная формула угольной кислоты записывается , а не как-то иначе.
(Сначала идут два катиона водорода, а за ними карбонат-анион).
Но почему брутто-формула записывается ?
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
ведь в ней нет повторяющихся элементов. В отличие от или
.
Но к брутто-формулам очень часто применяется дополнительное правило, определяющее порядок следования элементов.
Правило довольно простое: сначала ставится углерод, затем водород, а дальше остальные элементы в алфавитном порядке.
Вот и выходит — углерод, водород, кислород.
Это называется системой Хилла. Она используется практически во всех химических справочниках. И в этой статье тоже.
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
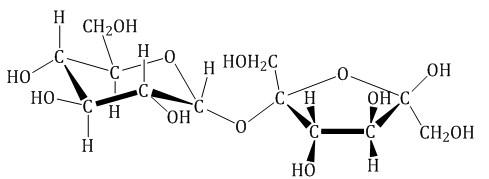
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
|
Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + 6H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Углеводороды
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Брутто-формула |
|---|---|---|---|
| Этан |
Здесь представлены органические вещества, называемые углеводородами.
Название означает, что они состоят только из углерода и водорода.
Эти вещества в различной мере входят в состав нефти. И это далеко не полный список.
Но сначала смотрим ту колонку, которая называется Развёрнутая структурная формула.
Мы видим уже знакомые буквы C и H, соединённые химическими связями — палочками.
Главное правило по-прежнему в силе: у каждой буквы C четыре палочки, а у каждой H — одна.
Что здесь нового? Появились химические связи между атомами углерода.
И в результате оказалось, что молекулы органических веществ могут строиться при помощи таких цепочек,
где звеньями являются атомы углерода с прилипшими к ними водородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Несложно догадаться, что они призваны экономить время людей, которые постоянно пишут формулы.
Особенно, если эти формулы достаточно большие.
Правила здесь довольно простые — убираем палочки между углеродом и водородом и пишем число атомов водорода в виде числа.
Таким образом, звенья цепочки становятся видны гораздо более отчётливо. По-научному они называются функциональные группы.
Можно даже довольно быстро понять некоторые более хитрые закономерности.
Например, группа на конце цепочки записывается ,
а в середине цепочки — .
А для ещё большей экономии повторяющиеся группы можно объединить в скобочках, подписав количество повторов.
Это показано в последней строке таблицы для формулы гексана: .
Некоторые функциональные группы получают собственные названия и даже специальные обозначения.
Например, группа называется метильная группа (от названия метана)
и имеет собственное обозначение: Me. Если Вам попадётся, к примеру, такая формула: ,
то ничего страшного тут нет. Это то же самое, что , то есть — пропан.
Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Но пока что мы познакомились только с одинарными химическими связями.
Но на самом деле существуют двойные и даже тройные связи. Посмотрим на следующую таблицу.
| Вещество | Развёрнутая формула | Упрощённая формула | Брутто-фломула |
|---|---|---|---|
| Этен (Этилен) | |||
| Пропен (Пропилен) | |||
| Бутен (Бутилен) | |||
| Этин (Ацетилен) | |||
| Пропин(Метилацетилен) | |||
| Бутин(Этилацетилен) |
Представленные здесь вещества тоже относятся к углеводородам.
Если хорошенько присмотреться, то можно увидеть определённое сходство с веществами из первой таблицы.
Названия формируются заменой буквы в конце названия: этан — этен — этин или
пропан — пропен — пропин. Сходство не ограничивается названиями.
Главное — одинаковое количество атомов углерода. А значит — одинаковое количество звеньев в цепи.
Различие кроется в наличии двойных и тройных связей.
Углеводороды в первой таблице называются предельными.
Это означает, что к ним больше ничего нельзя добавить.
А во второй таблице представлены непредельные углеводороды.
То есть, при определённых условиях к ним можно добавить по парочке атомов водорода.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного.
Верхние названия, которые без скобок — это научные названия.
А в скобках даны традиционные названия, которые тоже довольно часто употребляются как в научной литературе, так и в быту.
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
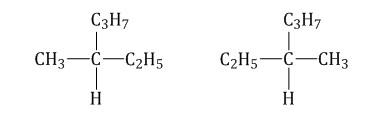
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
| Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
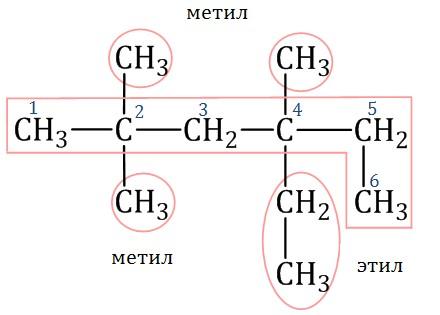
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
Свойства
Циклоалканы по физическим и химическим свойствам близки алканам. В обычных условиях первые три гомолога – газы. Соединения, содержащие от пяти до 11 атомов углерода – жидкости. Высшие нафтены с 12 и более атомами углерода – твёрдые вещества.
Рис. 3. Циклододекан
Температуры плавления и кипения увеличиваются с увеличением молекулярной массы. Однако нафтены плавятся и кипят при более высоких температурах, чем соответствующие алканы.
Низшие цикланы – циклопропан и циклобутан – сходны с алкенами и способны вступать в реакции присоединения. Циклоалканы выше циклопентана схожи с алканами и вступают в реакцию замещения. Основные химические свойства циклопарафинов описаны в таблице.
|
Реакция |
Описание |
Уравнения реакций |
|
Галогенирование |
Циклопропан и циклобутан присоединяют галогены. Начиная с циклопентана, нафтены вступают в реакцию замещения с галогенами |
|
|
Гидрирование |
Циклопропан и циклобутан присоединяют водород при нагревании в присутствии никеля |
C4H8 + H2 → CH3-CH2-CH2-CH3 |
|
Присоединение галогеноводородов |
Циклопропан и циклобутан присоединяют галогеноводороды |
C3H6 + HI → CH3-CH2-CH2I |
|
Дегидрирование |
Нафтены от циклопентана и выше дегидрируются в присутствии катализатора |
C6H12 C6H6 + 3H2 |
|
Окисление |
Окисление в присутствии катализатора |
C6H12 + 2O2 C6H10O4 |
Нафтены применяются для синтеза спиртов, кетонов, кислот, полимеров, используются в качестве растворителей.
Что мы узнали?
Циклоалканы или нафтены – циклические предельные углеводороды, схожие свойствами с алканами. Имеют циклическую структуру разной формы. Могут образовывать межклассовые, углеродные и структурные изомеры. Малоактивные вещества в обычных условиях. В присутствии катализатора циклопропан и циклобутан вступают в реакции присоединения с галогенами, галогеноводородами, водородом. Начиная с циклопентана, циклоалканы вступают в реакцию замещения с галогенами, а также окисляются и дегидрируются.
Немного о системе easyChem
Вместо заключения мне хотелось бы рассказать о системе easyChem.
Она разработана для того, чтобы все те формулы, которые мы тут обсуждали,
можно было легко вставить в текст.
Собственно, все формулы в этой статье нарисованы при помощи easyChem.
Зачем вообще нужна какая-то система для вывода формул?
Всё дело в том, что стандартный способ отображения информации в интернет-браузерах — это язык гипертекстовой разметки (HTML).
Он ориентирован на обработку текстовой информации.
Рациональные и брутто-формулы вполне можно изобразить при помощи текста.
Даже некоторые упрощённые структурные формулы тоже могут быть записаны текстом,
например спирт .
Хотя для этого пришлось бы в HTML использовать такую запись:
.
Это конечно создаёт некоторые трудности, но с ними можно смириться. Но как изобразить структурную формулу?
В принципе, можно использовать моноширинный шрифт:
H H
| |
H-C-C-O-H
| |
H H
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Здесь не остаётся иного пути, кроме подключения растрового изображения.
Растры хранятся в отдельных файлах. Браузеры могут подключать изображения в формате gif, png или jpeg.
Для создания таких файлов требуется графический редактор. Например, Фотошоп.
Но я более 10 лет знаком с Фотошопом и могу сказать точно, что он очень плохо подходит для изображения химических формул.
Гораздо лучше с этой задачей справляются
молекулярные редакторы.
Но при большом количестве формул, каждая из которых хранится в отдельном файле, довольно легко в них запутаться.
Например, число формул в этой статье равно .
Из них выведены виде графических изображений (остальные при помощи средств HTML).
Система easyChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Кроме того, брутто-формулы в этой статье вычисляются автоматически.
Потому что easyChem работает в два этапа: сначала текстовое описание преобразуется в информационную структуру (граф),
а затем с этой структурой можно выполнять различные действия.
Среди них можно отметить следующие функции: вычисление молекулярной массы, преобразование в брутто-формулу,
проверка на возможность вывода в виде текста, графическая и текстовая отрисовка.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором.
Причём, мне не пришлось думать, какая из формул будет графической, а какая — текстовой.
| Текстовое описание easyChem | Выводимый результат | Сгенерированная брутто-формула |
|---|---|---|
| (NH4)2CO3 | ||
| H-C-C-O-H; H|#2|H; H|#3|H | ||
| CH3|\\|`//`\`||/ |
Здесь есть гораздо более подробная документация по использованию системы easyChem.
На этом разрешите закончить статью и пожелать удачи в изучении химии.
Ссылки
- ↑
- Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel’s Textbook of Practical Organic Chemistry (5th ed.), Harlow: Longman, p. 864, ISBN 0-582-46236-3
- Shaw, J. E.; Kunerth, D. C.; Sherry, J. J. Tetrahedron Lett. 1973, 689.
-
(a) Greene, T. W.; Wuts, P. G. M., Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. (b)
Protective Groups in Organic Chemistry, McOmie, J. F. W., Ed.; Plenum: New York, 1973. - Fletcher, H. G., Methods Carbohydr. Chem. 1963, 166.
- Freedman, H. H.; Dubois, R. A. Tetrahedron Lett. 1975, 3251.
- Kuhn, R.; Löw, I.; Trischmann, H. Chem. Ber. 1957, 90, 203.
- Heer, J.; Billeter, J. R.; Miescher, K. Helv. Chim. Acta 1945, 28, 991
- Yamashita, M.; Takegami, Y. Synthesis 1977, 803.
- Velluz, L.; Amiard, G.; Heymès, R. Bull. Soc. Chim. Fr., Part 2 1954, 1012.
- (a) Frankel, M.; Gertner, D.; Jacobson, H.; Zilkha, A. J. Chem. Soc. 1960, 1390. (b) Vogtle, F.; Klieser, B. S 1982, 294.
- (a) Xia, Y.; Kozikowski, A. P. J. Am. Chem. Soc. 1989, 111, 4116. (b) Bryant, D. R.; Work, S. D.; Hauser, C. R. J. Org. Chem. 1964, 29, 235.
- (a) Elsinger, F. OS 1973, 5, 76. (b) Stork, G.; McElvain, S. M. J. Am. Chem. Soc. 1946, 68, 1053
- Cope, A. C.; Holmes, H. L.; House, H. O. Org. React. 1957, 9, 107.
- Ravikumar, V. T.; Sathyamoorthi, G.; Thangaraj, K.; Rajagopalan, K. Indian J. Chem., Sect. B 1985, 24, 959
- Hauser, C. R.; Harris, T. M. J. Am. Chem. Soc. 1958, 80, 6360.
- Hubbard, J. S.; Harris, T. M. Tetrahedron Lett. 1978, 4601.
- Baraldi, P. G.; Pollini, G. P.; Zanirato, V. Synthesis 1985, 969.
- Arseniyadis, S.; Kyler, K. S.; Watt, D. S. Org. React. 1984, 31, 1.
- Bates, G. S.; Ramaswamy, S. Can. J. Chem. 1980, 58, 716.
- Muller-Uri, C.; Singer, E. A.; Fleischacker, W. J. Med. Chem. 1986, 29, 125
- (a) Stork, G.; Dowd, S. R. J. Am. Chem. Soc. 1963, 85, 2178. (b) Hosomi, A.; Araki, Y.; Sakurai, H. J. Am. Chem. Soc. 1982, 104, 2081
- Henoch, F. E.; Hampton, K. G.; Hauser, C. R. J. Am. Chem. Soc. 1969, 91, 676.
Химические свойства глюкозы
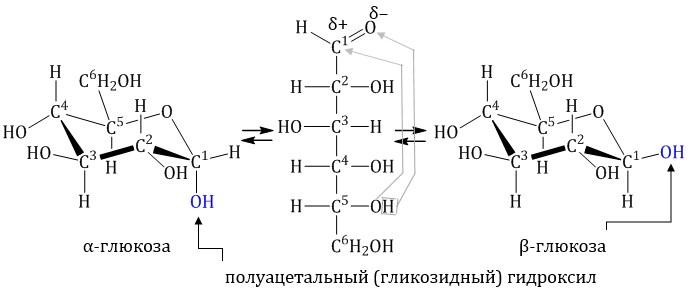
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
Реакция «серебряного зеркала»
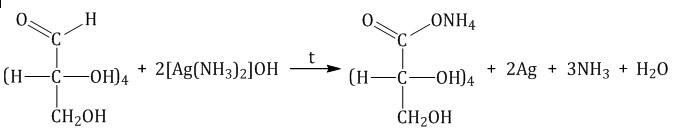
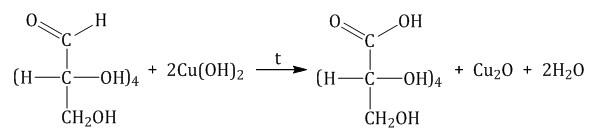
Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
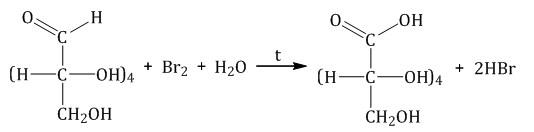
Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
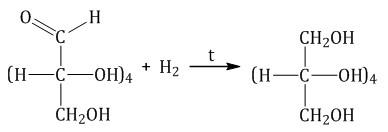
Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
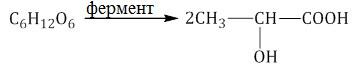
Маслянокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
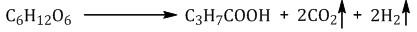
Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
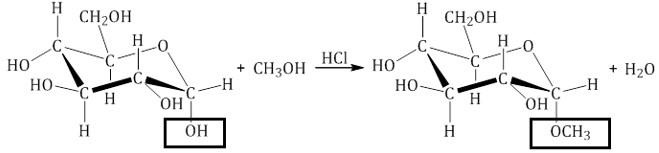
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
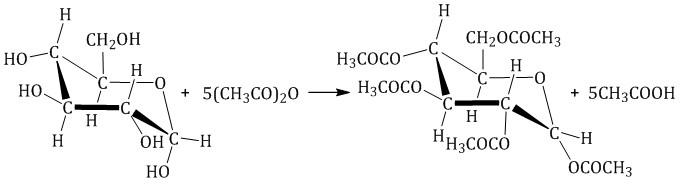
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |