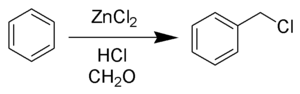
Толуол
Содержание:
Химические свойства
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
-
- 8HI+H2SO4=4I2↓+H2S↑+4H2O{\displaystyle {\mathsf {8HI+H_{2}SO_{4}=4I_{2}\downarrow +H_{2}S\uparrow +4H_{2}O}}}
-
- 2HBr+H2SO4=Br2↓+SO2↑+2H2O{\displaystyle {\mathsf {2HBr+H_{2}SO_{4}=Br_{2}\downarrow +SO_{2}\uparrow +2H_{2}O}}}
Углерод до CO2, серу — до SO2.
-
- C+2H2SO4=2SO2↑+CO2↑+2H2O{\displaystyle {\mathsf {C+2H_{2}SO_{4}=2SO_{2}\uparrow +CO_{2}\uparrow +2H_{2}O}}}
-
- S+2H2SO4=3SO2↑+2H2O{\displaystyle {\mathsf {S+2H_{2}SO_{4}=3SO_{2}\uparrow +2H_{2}O}}}
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например:
-
- Cu+2H2SO4=CuSO4+2H2O+SO2{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+2H_{2}O+SO_{2}}}}
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:
-
- Fe+H2SO4=FeSO4+H2↑{\displaystyle {\mathsf {Fe+H_{2}SO_{4}=FeSO_{4}+H_{2}{\uparrow }}}}
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
-
- H2SO4+2NaOH=Na2SO4+2H2O{\displaystyle {\mathsf {H_{2}SO_{4}+2NaOH=Na_{2}SO_{4}+2H_{2}O}}}
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
-
- CuO+H2SO4=CuSO4+H2O{\displaystyle {\mathsf {CuO+H_{2}SO_{4}=CuSO_{4}+H_{2}O}}}
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
-
- Fe2O3+3H2SO4=Fe2(SO4)3+3H2O{\displaystyle {\mathsf {Fe_{2}O_{3}+3H_{2}SO_{4}=Fe_{2}(SO_{4})_{3}+3H_{2}O}}}
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
-
- HCOOH+H2SO4(k)=CO↑+H2SO4⋅nH2O{\displaystyle {\mathsf {HCOOH+H_{2}SO_{4}(k)=CO\uparrow +H_{2}SO_{4}\cdot nH_{2}O}}}
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
-
- H2SO4+BaCl2=BaSO4↓+2HCl{\displaystyle {\mathsf {H_{2}SO_{4}+BaCl_{2}=BaSO_{4}{\downarrow }+2HCl}}}
Интересные факты о серной кислоте
- Серная кислота в чистом 100%-ом виде встречается в природе. К примеру, в Италии на Сицилии в Мертвом море можно увидеть уникальное явление – серная кислота просачивается прямо из дна! А происходит вот что: пирит из земной коры служит в этом случае сырьем для ее образования. Это место еще называют Озером смерти, и к нему боятся подлетать даже насекомые!
- После больших извержений вулканов в земной атмосфере часто можно обнаружить капли серной кислоты, и в таких случаях «виновница» может принести негативные последствия для окружающей среды и стать причиной серьезных изменений климата.
- Серная кислота является активным поглотителем воды, поэтому ее используют в качестве осушителя газов. В былые времена, чтобы в помещениях не запотевали окна, эту кислоту наливали в баночки и ставили между стеклами оконных проемов.
- Именно серная кислота – основная причина выпадения кислотных дождей. Главная причина образования кислотного дождя – загрязнение воздуха диоксидом серы, и он при растворении в воде образует серную кислоту. В свою очередь двуокись серы выделяется при сжигании ископаемого топлива. В кислотных дождях, исследуемых за последние годы, возросло содержание азотной кислоты. Причина такого явления – снижение выбросов двуокиси серы. Несмотря на этот факт, основной причиной появления кислотных дождей так и остается серная кислота.
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
-
Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
-
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло, работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции. Полностью механизм реакции был описан только в 2020 году сотрудниками Института органической химии им. Н. Д. Зелинского РАН.
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
-
- C6H6+H2C=CH2→AlCl3∗HClC6H5CH2CH3{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}C=CH_{2}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH_{2}CH_{3}}}}
-
- C6H6+CH2=CH−CH3→AlCl3∗HClC6H5CH(CH3)2{\displaystyle {\mathsf {C_{6}H_{6}+CH_{2}=CH-CH_{3}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH(CH_{3})_{2}}}}
Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
-
- C6H6+Cl2→FeCl3C6H5Cl+HCl{\displaystyle {\mathsf {C_{6}H_{6}+Cl_{2}{\xrightarrow{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}}
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
-
- C6H6+3Cl2→T,hνC6H6Cl6{\displaystyle {\mathsf {C_{6}H_{6}+3Cl_{2}{\xrightarrow{T,h\nu }}C_{6}H_{6}Cl_{6}}}}
При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
-
- C6H6+6Br2→H2SO4∗SO3C6Br6+6HBr{\displaystyle {\mathsf {C_{6}H_{6}+6Br_{2}{\xrightarrow{H_{2}SO_{4}*SO_{3}}}C_{6}Br_{6}+6HBr}}}
Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
-
- C6H6+(CH3CO)2O→AlCl3C6H5COCH3+CH3COOH{\displaystyle {\mathsf {C_{6}H_{6}+(CH_{3}CO)_{2}O{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COCH_{3}+CH_{3}COOH}}}
-
- C6H6+C6H5COCl→AlCl3C6H5COC6H5+HCl{\displaystyle {\mathsf {C_{6}H_{6}+C_{6}H_{5}COCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COC_{6}H_{5}+HCl}}}
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С.
В третьей реакции образуется бензофенон (дифенилкетон).
Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
-
- C6H6+CO+HCl→AlCl3C6H5COH+HCl{\displaystyle {\mathsf {C_{6}H_{6}+CO+HCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COH+HCl}}}
Реакции сульфирования и нитрования (электрофильное замещение):
-
- C6H6+HNO3→H2SO4C6H5NO2+H2O{\displaystyle {\mathsf {C_{6}H_{6}+HNO_{3}{\xrightarrow{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}}
-
- C6H6+H2SO4→C6H5SO3H+H2O{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}SO_{4}\rightarrow C_{6}H_{5}SO_{3}H+H_{2}O}}}
Восстановление бензола водородом (каталитическое гидрирование):
-
- C6H6+3H2→NiPd,Pt;tC6H12{\displaystyle {\mathsf {C_{6}H_{6}+3H_{2}{\xrightarrow{Ni/Pd,Pt;t}}C_{6}H_{12}}}}
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем (содержит до 92% углерода в молекуле):
-
- 2C6H6+15O2→12CO2+6H2O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O}}}
Применение [ править | править код ]
- как растворитель в лакокрасочной промышленности, в производстве смол и пластификаторов
- модификаторы мочевино- и меламино-формальдегидных смол
- для получения пластификаторов: дибутилфталата, трибутилфосфата
- для получения бутилацетата и бутилакрилата и эфиров с гликолями
- в синтезе многих органических соединений.
Применение в качестве автомобильного топлива
Может, но не обязательно должен, смешиваться с традиционными топливами. Энергия бутанола близка к энергии бензина. Бутанол может использоваться в топливных элементах, как сырьё для производства водорода.
В 2007 году в Великобритании начались продажи биобутанола в качестве добавки к бензину.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной.
Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
Взаимодействие с перманганатом калия в кислой среде:
- 5C6H5CH3+6KMnO4+9H2SO4→,{\displaystyle {\mathsf {5C_{6}H_{5}CH_{3}+6KMnO_{4}+9H_{2}SO_{4}\rightarrow }},}
- →5C6H5COOH+6MnSO4+3K2SO4+14H2O.{\displaystyle {\mathsf {\rightarrow 5C_{6}H_{5}COOH+6MnSO_{4}+3K_{2}SO_{4}+14H_{2}O}}.}
Взаимодействие с перманганатом калия в нейтральной среде
- C6H5CH3+2KMnO4→C6H5COOK+2MnO2+KOH+H2O.{\displaystyle {\mathsf {C_{6}H_{5}CH_{3}+2KMnO_{4}\rightarrow C_{6}H_{5}COOK+2MnO_{2}+KOH+H_{2}O}}.}
Взаимодействие с галогенами на свету:
-
- C6H5CH3+X2→hνC6H5CH2X+HX.{\displaystyle {\mathsf {C_{6}H_{5}CH_{3}+X_{2}{\xrightarrow{h\nu }}C_{6}H_{5}CH_{2}X+HX}}.}
Проблемы при измерении плотности
Пузырьки
Безусловно, самой большой источник ошибок при измерении плотности — ограниченная смачиваемость образца
При погружении образца в жидкость крайне важно избавиться от всех пузырьков, которые прилипают к образцу и поверхностям оборудования. Любые оставшиеся пузырьки увеличивают выталкивающую силу и искажают расчет
(Пузырек диаметром 1 мм создает выталкивающую силу 0,5 мг.) МЕТТЛЕР ТОЛЕДО рекомендует:
- Пользуйтесь смачивающим реагентом или органическими жидкостями (изменением плотности дистиллированной воды при добавлении пары капель смачивающего реагента можно пренебречь).
- Обезжиривайте твердые вещества, стойкие к действию растворителей.
- Регулярно очищайте оборудование.
- Не прикасайтесь к погружаемым компонентам голыми руками.
- Используйте тонкую кисть для удаления оставшихся пузырьков воздуха.
Температура
Твердые вещества обычно настолько нечувствительны к колебаниям окружающей температуры, что соответствующее изменение их плотности пренебрежимо мало. Однако поскольку в измерении участвует вспомогательная жидкость, температуру необходимо учитывать. На жидкости температура оказывает большее влияние и вызывает изменение плотности от 0,1 до 1 ‰ на 1 °C.
Этот эффект заметен уже в третьем знаке после запятой. Для получения точных результатов рекомендуем во всех измерениях плотности всегда учитывать температуру вспомогательной жидкости. Эти значения можно найти в специальных справочных таблицах. Плотности наиболее важных эталонных жидкостей (H2O и этанола) хранятся в памяти весов.
Взвешивание
Как было сказано выше, взвешивание играет значимую роль в точном определении плотности, поэтому важно использовать подходящие весы. Из-за небольшой массы образцов необходимо учитывать ограничения прибора по минимальному весу нетто
Если масса взвешиваемого образца меньше этого значения, нужный уровень точности не может быть гарантирован.
Обработка данных
Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
-
- H2SO4+SO3→H2S2O7;{\displaystyle {\mathsf {H_{2}SO_{4}+SO_{3}\rightarrow H_{2}S_{2}O_{7}}};} Сульфит
-
- H2SO4+2SO3→H2S3O10.{\displaystyle {\mathsf {H_{2}SO_{4}+2SO_{3}\rightarrow H_{2}S_{3}O_{10}}}.}
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
-
- lgp = A − BT + 2,126,{\displaystyle \lg p\ {=}\ {\rm {{A}\ {-}\ {B \over {\it {T}}}\ {+}\ 2{,}126{,}}}}
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
-
- H2SO4↽−−⇀SO3+H2O−Q{\displaystyle {\ce {H2SO4 <=> SO3 + H2O — Q}}}
Уравнение температурной зависимости константы равновесия:
-
- lnKp=14,74965−6,71464ln298T−8,10161⋅104T2−9643,04T−9,4577⋅10−3T+2,19062⋅10−6T2.{\displaystyle \ln {\it {K_{p}}}=14{,}74965-6{,}71464\ln {298 \over {\it {T}}}-8{,}10161\cdot 10^{4}{\it {{T^{2}}-{{\rm {9643{,}04}} \over {\it {T}}}-{\rm {9{,}4577\cdot 10^{-3}{\it {{T}+{\rm {2{,}19062\cdot 10^{-6}{\it {{T^{2}}.}}}}}}}}}}}
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
-
- d=1,8517−1,1⋅10−3t+2⋅10−6t2.{\displaystyle {\it {{d}={\rm {1{,}8517-1{,}1\cdot 10^{-3}{\it {{t}+{\rm {2\cdot 10^{-6}{\it {{t^{2}}.}}}}}}}}}}}
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
-
- λ=0,518+0,0016t−(,25+t1293)⋅C100,{\displaystyle {\rm {\lambda =0{,}518+0{,}0016{\it {{t}-{\rm {(0{,}25+{\it {{t}/{\rm {{1293})\cdot {\it {{C}/{\rm {100,}}}}}}}}}}}}}}}
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4[источник не указан 3181 день]. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Получение серной кислоты
Производство серной кислоты в промышленных масштабах было запущено в XV веке, но в то время ее называли “купоросное масло». Если раньше человечество потребляло всего лишь несколько десятков литров серной кислоты, то в современном мире исчисление идет на миллионы тонн в год.
Производство серной кислоты осуществляется промышленным способом, и их существует три:
- Контактный способ.
- Нитрозный способ
- Другие методы
Поговорим подробно о каждом из них.
Контактный способ производства
Контактный способ производства – самый распространенный, и он выполняет следующие задачи:
- Получается продукт, удовлетворяющий потребности максимального количества потребителей.
- Во время производства сокращается вред для окружающей среды.
При контактном способе в качестве сырья используются такие вещества:
- пирит (серный колчедан);
- сера;
- оксид ванадия (это вещество вызывает роль катализатора);
- сероводород;
- сульфиды различных металлов.
Перед запуском процесса производства сырье предварительно подготавливают. Для начала в специальных дробильных установках колчедан подвергается измельчению, что позволяет, благодаря увеличению площади соприкосновения активных веществ, ускорить реакцию. Пирит подвергается очищению: его опускают в большие емкости с водой, в ходе чего пустая порода и всевозможные примеси всплывают на поверхность. В конце процесса их убирают.
Производственную часть разделяют на несколько стадий:
- После дробления колчедан очищают и отправляют в печь – там при температуре до 800 °C происходит его обжиг. По принципу противотока в камеру снизу идет подача воздуха, и это обеспечивает нахождение пирита в подвешенном состоянии. На сегодняшний день, на этот процесс тратится несколько секунд, а вот раньше на обжиг уходило несколько часов. В процессе обжига появляются отходы в виде оксида железа, которые удаляются, и в дальнейшем передаются на предприятия металлургической промышленности. При обжиге выделяются водные пары, газы O2 и SO2. Когда завершится очистка от паров воды и мельчайших примесей, получается чистый оксид серы и кислород.
- На второй стадии под давлением происходит экзотермическая реакция с использованием ванадиевого катализатора. Запуск реакции начинается при достижении температуры 420 °C, но ее могут повысить до 550 °C с целью увеличения эффективности. В процессе реакции идет каталитическое окисление и SO2 становится SO3.
- Суть третьей стадии производства такова: поглощение SO3 в поглотительной башне, в ходе чего образуется олеум H2SO4. В таком виде H2SO4 разливается в специальные емкости (она не вступает в реакция со сталью) и готова ко встрече с конечным потребителем.
В ходе производства, как мы уже говорили выше, образуется много тепловой энергии, которая используется в отопительных целях. Многие предприятия по производству серной кислоты устанавливают паровые турбины, которые использую выбрасываемый пар для вырабатывая дополнительной электроэнергии.
Нитрозный способ получения серной кислоты
Несмотря на преимущества контактного способа производства, при котором получается более концентрированная и чистая серная кислота и олеум, достаточно много H2SO4 получают нитрозным способом. В частности, на суперфосфатных заводах.
Для производства H2SO4 исходным веществом, как в контактном, так и в нитрозном способе выступает сернистый газ. Его получают специально для этих целей посредством сжигания серы или обжигом сернистых металлов.
Переработка сернистого газа в сернистую кислоту заключается в окислении двуокиси серы и присоединении воды. Формула выглядит так:
SO2 + 1|2 O2 + H2O = H2SO4
Но двуокись серы с кислородом не вступает в непосредственную реакцию, поэтому при нитрозном методе окисление сернистого газа осуществляют при помощи окислов азота. Высшие окислы азота (речь идет о двуокиси азота NO2, трехокиси азота NO3) при данном процессе восстанавливаются до окиси азота NO, которая впоследствии опять окисляется кислородом до высших окислов.
Получение серной кислоты нитрозным способом в техническом плане оформлено в виде двух способов:
- Камерного.
- Башенного.
Нитрозный способ имеет ряд достоинств и недостатков.
Недостатки нитрозного способа:
- Получается 75%-ная серная кислота.
- Качество продукции низкое.
- Неполный возврат оксидов азота (добавление HNO3). Их выбросы вредны.
- В кислоте присутствуют железо, оксиды азота и прочие примеси .
Достоинства нитрозного способа:
- Себестоимость процесса более низкая.
- Возможность переработки SO2 на все 100%.
- Простота аппаратурного оформления.
Плотность — раствор — серная кислота
Плотность раствора серной кислоты, заливаемой в автомобильные аккумуляторы, должна соответствовать климатическому поясу и времени года ( зимой она выше); температура заливаемого электролита не должна превышать 25 С.
|
Интегральные теплоты смешения серной кислоты, жидкого и газообразного триоксида серы с водой. |
Плотность растворов серной кислоты ( см. Приложение IX) необходимо знать при определении объемов емкостей, при расчетах гидравлического сопротивления кислото-проводов и змеевиков холодильников и в ряде других случаев.
Измеряют плотность раствора серной кислоты. По таб Лице находят процентное содержание H2SO4 в растворе. Рассчитывают необходимое количество миллилитров для, приготовления нужного объема кислоты заданной концентрации. Отмеряют это количество кислоты и доливают объем до метки.
Измеряют плотность раствора серной кислоты. По таблице находят процентное содержание H2SO4 в растворе. Рассчитывают необходимое количество миллилитров для приготовления нужного объема кислоты заданной концентрации. Отмеряют это количество кислоты и доливают объем до метки.
С увеличением плотности растворов серной кислоты до 1 29 температура замерзания все время снижается. Дальнейшие аномалии в изменении температуры связаны с образованием различных гидратов серного ангидрида.
Концентрацию растворов, применяемых в качестве электролитов электрических аккумуляторов, часто выражают в единицах плотности ( удельного веса) раствора. Плотность растворов серной кислоты, едкого натра и едкого калия сильно зависит от содержания соответствующего электролита, что и дает возможность выражать концентрацию таких растворов непосредственно в единицах плотности. Соотношения между плотностью растворов и их процентной концентрацией сведены в специальные таблицы.
В разряженном состоянии аккумуляторный раствор содержит 12 — 24 % ( мае. Обычно степень заряженное контролируют по плотности раствора, которая отвечает плотности раствора серной кислоты и раство ренного сульфата свинца.
Доминирующим фактором является концентрация серной кислоты. В табл. 39 приведены данные, иллюстрирующие влияние плотности электролита на срок службы положительного электрода. Влияние плотности серной кислоты на срок службы при заряде противоположно влиянию при разряде. С повышением плотности раствора серной кислоты при заряде срок службы увеличивается, а при разряде уменьшается, причем в значительно большей степени, чем увеличивается при заряде.
|
Зависимость плотности растворов серной кислоты от их концентрации. |
Кислоту серную — H2SO4, M98 08, применяют в качестве катализатора при изготовлении мочевиноформальдегидных клеящих смол. Получают из природных соединений серы. Используют в виде разбавленных растворов. На рис. 5 приведена зависимость плотности растворов серной кислоты от их концентрации.